¿En qué consiste?
La enfermedad de Alzheimer (EA) es una forma irreversible de demencia caracterizada por una pérdida de memoria progresiva, un deterioro de la capacidad intelectual y del lenguaje y cambios en el comportamiento y en la personalidad que interfieren en el día a día del individuo afectado. Se estima que en España más de 800.000 personas padecen la enfermedad de Alzheimer, habiendo aproximadamente unos 44 millones de personas afectadas por esta demencia a nivel mundial.
Aunque en la enfermedad de Alzheimer se producen algunos cambios neurológicos similares a los que acontecen a medida que el individuo envejece, estos no pueden considerarse como parte normal del proceso de envejecimiento. La EA genera lesiones en las células del sistema nervioso central, caracterizándose por la aparición de placas seniles (áreas de células nerviosas muertas con depósitos de la proteína beta-amiloide) y ovillos neurofibrilares (filamentos de la proteína Tau enrollados en el interior de las células nerviosas). La destrucción de células nerviosas resulta en una disminución de los niveles de ciertos neurotransmisores en el cerebro como la acetilcolina. Los neurotransmisores son sustancias químicas necesarias para asegurar una correcta comunicación entre las células nerviosas. Con el tiempo, en la enfermedad de Alzheimer se produce una disminución de la interacción normal entre las distintas áreas del cerebro.
Relación con la edad
El riesgo de padecer la enfermedad de Alzheimer entre otros tipos de demencia aumenta con la edad, de tal modo que aproximadamente entre un 10% y un 12% de la población presenta alguna forma de demencia al alcanzar los 65 años de edad, elevándose este porcentaje hasta un 50% a los 100 años de edad. La Organización Mundial de la Salud (OMS) estima que en el año 2050, habrá aproximadamente unos 130 millones de individuos afectados por la enfermedad de Alzheimer a nivel mundial.
En general, la enfermedad de Alzheimer es de aparición tardía, sus primeros síntomas se producen después de los 65 años. Contrariamente, existen casos de EA de aparición precoz, antes de los 65 años, asociados a la presencia de variantes genéticas en algunos genes (como son el gen que codifica para la proteína precursora amiloide y los genes que codifican para las presenilinas). La forma de Alzheimer asociada a una herencia monogénica representa entre un 5% y un 10% de todos los casos.
Relación con factores genéticos
La enfermedad de Alzheimer parece estar causada por una variedad de factores, aunque muchos de ellos todavía no están totalmente elucidados. Como se ha comentado en el apartado anterior, la enfermedad de Alzheimer asociada con una herencia monogénica es menos frecuente y de presentación precoz. Se han asociado con la presencia de variantes genéticas en los genes: presenilina 1 (PSEN1), PSEN2 y APP. Los dos primeros codifican para unas proteínas llamadas presenilinas y el último codifica para la proteína precursora amiloide. La presencia de variantes genéticas en alguno de estos genes puede provocar la producción de proteínas anómalas que contribuyen a la formación de placas seniles causantes de la demencia. Solamente se requiere que una copia de estos genes se encuentre alterada para que se genere la EA, por lo que presentan una herencia autosómica dominante. Existe una probabilidad del 50% de que la variante genética se transmita a cada uno de los hijos del individuo afectado. Hasta la fecha, solamente han sido halladas variantes genéticas en estos tres genes en un número muy reducido de familias, sin haberse llegado a determinar con claridad su papel y función.
Actualmente se dispone de pruebas para estudiar la presencia de variantes genéticas en los genes PSEN1, ubicado en el cromosoma 14, PSEN2, localizado en el cromosoma 1 y APP, ubicado en el cromosoma 21. Es importante destacar que la solicitud de estas pruebas solamente se lleva a acabo en casos muy concretos, en los que la enfermedad se produce en edades muy tempranas (antes de los 65 años) o cuando existe una clara asociación familiar.
No se han identificado genes causantes de la enfermedad de Alzheimer de aparición tardía, aunque sí se ha relacionado la presencia de ciertas variantes genéticas en algunos genes con el aumento del riesgo de padecer la patología. Así, la presencia de variantes genéticas en genes de "susceptibilidad" permitirían explicar la razón por la que existe un riesgo aumentado de desarrollar EA de aparición tardía en individuos con antecedentes familiares.
El gen que codifica para la proteína apolipoproteína E (ApoE) se ha asociado a EA de aparición tardía. La ApoE es una proteína que contribuye al transporte de sustancias lipídicas (grasas y colesterol) en la sangre. El gen que codifica para la ApoE presenta tres alelos: e2, e3 y e4. Cada persona hereda dos copias del gen, que puede existir bajo una combinación de las tres formas citadas. El alelo más común, hallado en aproximadamente el 60% de la población, es el e3. La presencia del alelo e4 se ha asociado con los casos familiares de enfermedad de Alzheimer de aparición tardía.
La mayor parte de individuos con síndrome de Down, causado por una trisomía del cromosoma 21, pueden presentar alteraciones mentales a menudo asociadas a enfermedad de Alzheimer entre los 40 y los 50 años. Las alteraciones que se detectan en el cerebro de personas adultas con síndrome de Down son muy similares a las halladas en la EA. La copia extra del cromosoma 21 conlleva una producción aumentada de la proteína que se acumula y forma las placas seniles, de forma similar a lo que se observa en la EA. Como se ha comentado, el gen que codifica para la proteína precursora amiloide se localiza en el cromosoma 21. Los familiares de personas con síndrome de Down no presentan mayor riesgo de EA puesto que no tienen tres copias del cromosoma 21.
Otros factores de riesgo
El riesgo de padecer EA también está influido por otros factores: la diabetes de tipo 2 y otras formas leves de resistencia a la insulina, la obesidad, la hipertensión, la dislipemia, así como la exposición constante a marcadores de inflamación como la proteína C reactiva (PCR), pueden aumentar el riesgo de padecer la patología.
En el año 2011, un grupo de expertos liderado por la Alzheimer Association y el National Institute on Aging (NIA) de los National Institutes of Health publicó unos nuevos criterios diagnósticos de la enfermedad de Alzheimer:
- Enfermedad de Alzheimer en estadio preclínico: alteraciones medibles en los biomarcadores de la enfermedad, incluyendo pruebas de imagen cerebral y proteínas en líquido cefalorraquídeo (LCR) sin presencia de síntomas.
- Deterioro cognitivo leve (MCI, por sus siglas en inglés) debido a EA: alteraciones leves en la memoria y funciones del pensamiento que todavía no repercuten sobre las actividades diarias. Los pacientes con MCI pueden o no progresar a enfermedad de Alzheimer.
- Demencia debida a EA: alteraciones de la memoria, del pensamiento y del comportamiento asociados a EA que dificultan o imposibilitan la vida diaria.
Acerca de la enfermedad de Alzheimer
Signos y síntomas
La Alzheimer Association ha descrito 10 signos y síntomas para un diagnóstico precoz de la enfermedad. Mientras que algunos problemas de memoria son típicos de la edad, hay otros que son característicos de la EA:
- Pérdida de memoria que afecta a la vida cotidiana. Se olvida inmediatamente de lo que acaba de aprender e incluso de eventos o fechas importantes.
- Dificultad para planificar y solventar problemas sencillos como encargarse de los recibos y pagar las facturas.
- Las rutinas del trabajo o del hogar se convierten en actividades difíciles de realizar.
- Confusión sobre el espacio y el tiempo (no acordarse de que día es, donde esta o qué hora es).
- Dificultad para leer o para calcular las distancias.
- Problemas para hablar o escribir (olvidarse palabras, repetir siempre lo mismo y vocabulario pobre).
- Perder objetos con frecuencia y guardar objetos en sitios extraños.
- Comportamientos fuera de lugar o irracional.
- Abandono de actividades que antes realizaba tanto sociales, laborales como familiares.
- Cambios en la personalidad y el carácter (se vuelven agresivos, miedosos y con tendencia a la depresión).
Pruebas relacionadas
Hasta hace poco, no existían pruebas diagnósticas de la enfermedad de Alzheimer (EA) que pudieran aplicarse mientras el individuo estaba vivo. Así, el único diagnóstico definitivo de EA lo constituía el examen microscópico de una sección de tejido cerebral del individuo afecto una vez había fallecido. El patólogo evaluaba si existían las placas seniles y los ovillos neurofibrilares característicos de la EA. Como tanto las placas como las acumulaciones pueden también producirse en el proceso normal del envejecimiento, siempre debía compararse la muestra con una muestra control de tejido cerebral sin EA, procedente de un fallecido sano de la misma edad.
Recientemente, el National Institute on Aging of the National Institutes of Health (NIA-NIH) junto con la Alzheimer’s Association (AA) han propuesto unos nuevos criterios diagnósticos para la EA. Los principales cambios respecto a los criterios anteriores establecidos por The National Institute of Neurological and Communicative Disorders and Stroke and the Alzheimer’s Disease and Related Disorders Association (NINCDS-ADRDA) son la estratificación de la enfermedad en 3 fases y la incorporación de biomarcadores como potencial herramienta diagnóstica. Por otra parte, el nuevo consenso generado por el International Working Group for New Research Criteria for the Diagnosis of Alzheimer’s Disease especifica que los marcadores fisiopatológicos son los más útiles para establecer el diagnóstico de la enfermedad. Entre estos marcadores se incluyen varios analitos cuantificables en líquido cefalorraquídeo (LCR): la Aβ de 42 aminoácidos (Aβ42), la proteína tau total (T-tau) y su forma fosforilada en la posición 181 (P-tau181P). La medida conjunta de estos marcadores en el LCR permite no solamente el diagnóstico temprano de la forma esporádica de EA, sino que también permite identificarla en su fase preclínica con una sensibilidad y una especificidad ≥85%.
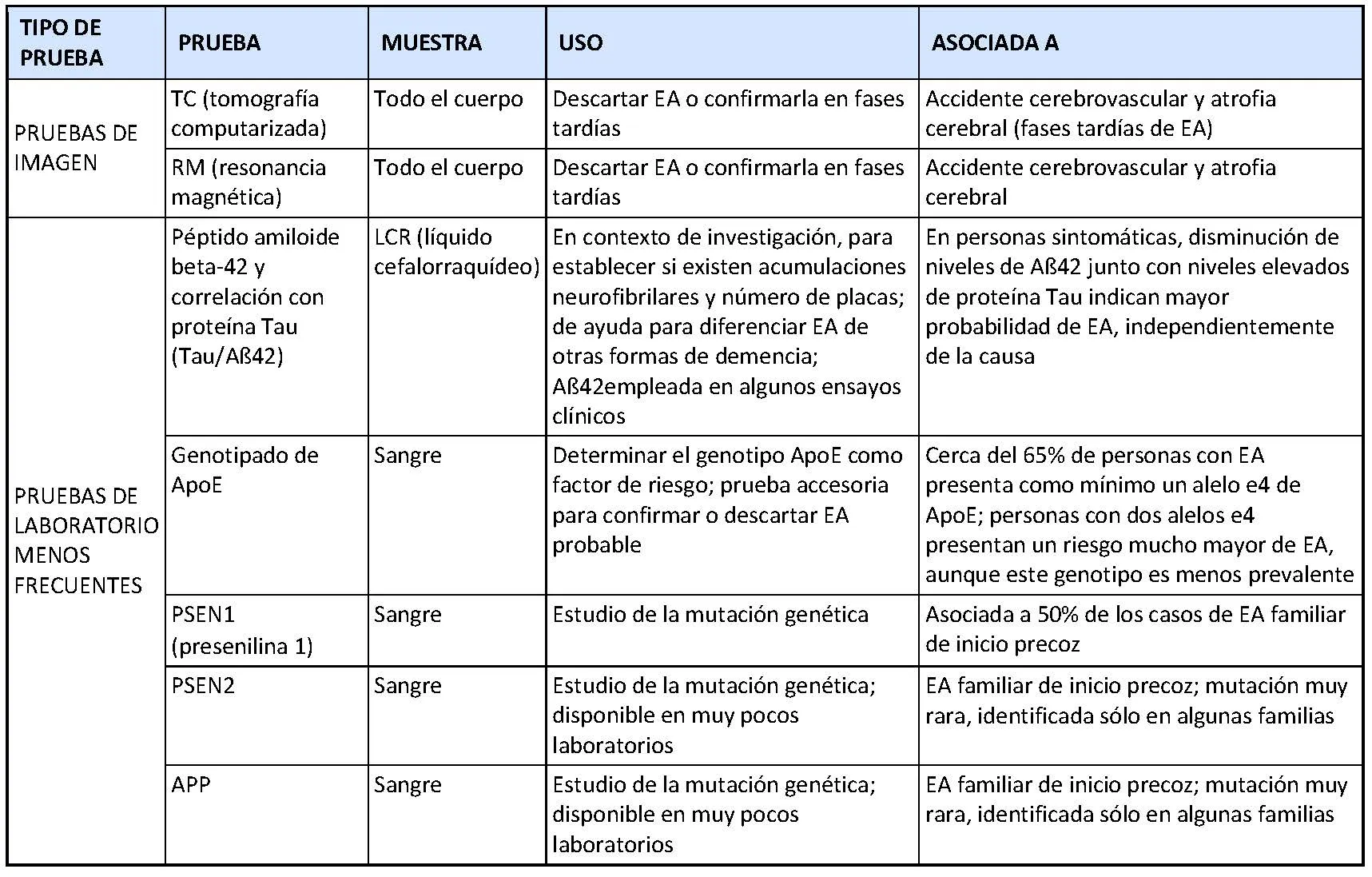
No obstante, los médicos también pueden descartar otras causas posibles de demencia mediante diversas pruebas clínicas y de laboratorio. Cuando un individuo acude con signos de demencia, el médico evalúa sus antecedentes personales y familiares (preferentemente de varias generaciones), realiza un examen físico y determina la edad de aparición de los signos clínicos. Además, realiza unas pruebas neuropsicológicas que evalúan la memoria, las habilidades de lenguaje y otras funciones cognitivas del individuo. También evalúa si la persona está sobremedicada y utiliza pruebas complementarias basadas en la imagen, como la tomografía computarizada (TC) y la resonancia magnética (RM), para descartar traumatismos, tumores y algún accidente cerebrovascular (ACV), que podrían también causar demencia. Finalmente, se examina si existe atrofia cerebral, normalmente observada en las fases más evolucionadas de la EA.
Pruebas útiles para descartar otras causas reversibles de demencia que no sea la enfermedad de Alzheimer

Es posible que si el médico sospecha una EA, realice otras pruebas de laboratorio con el objetivo de diferenciar una posible EA de otras formas de demencia, además de estudiar otros factores de riesgo genético si procede.
Otras pruebas útiles para categorizar las demencias
La investigación se sigue centrando en el hallazgo y utilidad de nuevos biomarcadores.
Tratamiento
En general, el tratamiento en la EA consiste en intentar retardar el progreso de la enfermedad, aliviando los síntomas, prestando especial atención a los aspectos referentes al comportamiento, y educando y dando soporte, tanto a las personas afectas como a las que los cuidan. Al principio de la enfermedad, las personas con EA son capaces de llevar una vida relativamente normal y con poca asistencia; necesitan solamente reforzar la memoria y un ambiente bien estructurado. Es en esta fase cuando todavía son capaces de participar en decisiones referentes a su futura calidad de vida. Es posible vivir padeciendo EA durante 25 años, aunque el período más habitual es de 8 a 10 años.
Si se consigue diagnosticar la EA pronto, el individuo puede beneficiarse de un tratamiento con inhibidores de la colinesterasa, fármacos que preservan las funciones intelectuales facilitando la función del neurotransmisor acetilcolina. Algunos ejemplos de estos fármacos son: la galantamina, el donezepil y la rivastigmina. Además, se debe tener en cuenta que otras medicaciones que esté tomando el individuo pueden empeorar el estado de confusión, por lo que deberán ser eliminados (depresores del sistema nervioso central, antihistamínicos, fármacos para conciliar el sueño y analgésicos).
Otro fármaco indicado para mejorar la memoria y la atención es la memantina. Este fármaco es un antagonista de los receptores NMDA (N-metil-D-aspartato), por lo que su acción se basa en la disminución de la acción excitatoria cerebral del glutamato. También se pueden prescribir antidepresivos y otros fármacos en pequeñas dosis para evitar los cambios de humor, la depresión, la paranoia y la violencia que se asocia a EA.
En los últimos años, se han aprobado dos nuevos fármacos (aducanumab y lecanemab) por la Food and Drug Administration (FDA) en Estados Unidos para el tratamiento de la EA. Sin embargo, aún no han sido aprobados por la Agencia Europea del Medicamento (EMA) por lo que no se están comercializando en Europa. Estos dos fármacos están basados en anticuerpos monoclonales.
A pesar de que los esfuerzos actuales en investigación de sustancias protectoras y terapéuticas son prometedores, todavía no hay ningún tratamiento específico para la enfermedad de Alzheimer. Es importante destacar que todos estos fármacos presentan unos riesgos asociados y producen reacciones adversas, por lo que son necesarios más estudios para determinar su eficacia real y su seguridad a largo plazo.
Preguntas comunes
¿Cuáles pueden ser otras causas de confusión, pérdida de memoria y deterioro cognitivo?
Los descuidos y pérdidas de memoria ocasionales no deben de ser un motivo de preocupación a menos que su frecuencia vaya en aumento o interfiriera con el día a día. Además, existen otras causas de deterioro cognitivo, como:
- Interacciones medicamentosas, efectos colaterales o sobremedicación. Por ello, es importante informar al médico acerca de todos los fármacos que se están tomando.
- Déficits nutricionales, como por ejemplo déficit de la vitamina B12.
- Trastornos o enfermedades que pueden contribuir a la aparición de alteraciones mentales, como la diabetes, la hipertensión, la enfermedad renal, la enfermedad hepática o las enfermedades tiroideas.
- Tumores cerebrales, traumatismos craneales e hidrocefalia.
- Enfermedades degenerativas, entre las que se incluyen el deterioro cognitivo asociado al envejecimiento, la enfermedad de Huntington, la enfermedad de Parkinson y la enfermedad de Pick.
- Enfermedades infecciosas como la infección por VIH o SIDA, la enfermedad de Creutzfeldt-Jakob, la meningitis, la encefalitis y la neurosífilis (relacionada con la enfermedad de sífilis en fases muy avanzadas).
- Ansiedad, depresión.
- Intoxicación por metales pesados (por ejemplo: plomo).
- Convulsiones.
¿Existe alguna manera de participar en los estudios de investigación relacionados con la enfermedad de Alzheimer?
Sí, es posible participar en ensayos clínicos. Por otra parte, se puede realizar donaciones del tejido cerebral de familiares fallecidos. Los investigadores necesitan muestras de tejido cerebral de individuos con EA, así como de ancianos sanos para avanzar en el estudio de las causas y para hallar mejores tratamientos.
Enlaces
Pruebas relacionadas:
Genotipado de ApoE, enfermedad de Alzheimer
Beta amiloide 42 (Aß42) y proteína tau
Noticias:
Biomarcadores de líquido cefalorraquídeo en la Enfermedad de Alzheimer
Nuevo análisis en plasma para detectar precozmente la enfermedad de Alzheimer
Nuevas técnicas diagnósticas para la enfermedad de Alzheimer
Nuevos posibles avances en el tratamiento de la enfermedad de Alzheimer
10 señales de demencia, la epidemia silenciosa
En otras webs:
Medline: Enfermedad de Alzheimer
MayoClinic: Enfermedad de Alzheimer
National Institute on Aging (NIH): Enfermedad de Alzheimer
Manual MSD: Enfermedad de Alzheimer
Fundación Pascual Maragall: El Alzheimer se lo lleva todo
Sociedad Española de Neurología (SEN)
Clínica Universidad de Navarra (CUN): Enfermedad de Alzheimer
Alzheimers.gov: ¿Qué es la enfermedad de Alzheimer?
Alzheimer's Association: Datos y cifras sobre la enfermedad de Alzheimer
Alzheimer Research Forum (ALZFORUM)
Pregúntenos














